第32回 Anesthesia Morning Café – Professor’s Wake-Up Bibble-Babble
皆さん、オピオイドの副作用として、耐性やオピオイド誘発性痛覚過敏の存在はご存じでしょう。耐性(tolerance)は、オピオイドの鎮痛効果が徐々に減ずることで、投与量の増加が必要になる状態です。オピオイド誘発性痛覚過敏(opioid-induced hyperalgesia: OIH)は、オピオイドの投与が痛覚過敏状態を誘発し、効果を求めてオピオイド投与量を増量することで、逆にさらに痛みが増大する状態です。オピオイドを慢性投与されている患者で生じると、まずは耐性なのかOIHなのか鑑別が必要ですが、これも容易ではなく、かつ治療としてオピオイドを増量するのか、スイッチングなのか、はたまたオピオイドを投与中止するのか、その後は鎮痛薬として何を使うのか、対応に非常に難渋する事象です。しかし耐性やOIHはオピオイドの慢性投与時にのみ生じるのではなく、急性投与、つまりは単回の麻酔中の投与によっても、急性耐性が起きている事実についてはご存じでしょうか?
われわれ麻酔科医は、鎮痛作用が強力で、超短時間作用性のオピオイドであるレミフェンタニルを得て、麻酔開始から終了時までを通して鎮痛をコントロールできる理想薬として、ほとんどの患者さんの麻酔に使用しています。モルヒネやアルフェンタニルなど様々なオピオイドで耐性は生じる中、強力でかつ超短時間作用性で持続投与を要するためかもしれませんが、レミフェンタニルは急性耐性を起こしやすいオピオイドのひとつなのです。麻酔中に0.25㎍/㎏/分以上の速度で、一定時間持続投与された場合に起こりやすくなると考えられています。以前より認識されている事象ですので、古い論文からご紹介します。
Vinik HR, Kissin I.
Rapid development of tolerance to analgesia during remifentanil infusion in humans.
Anesth Analg 1998; 86: 1307-11
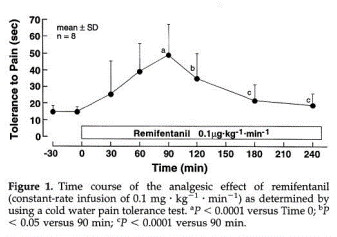
ボランティア対象に、レミフェンタニルを0.1㎍/㎏/分で4時間投与し、その間に冷水刺激や圧刺激テストで痛みの閾値を測定しています。Figure 1のように、最初のうちはレミフェンタニルの鎮痛効果により疼痛閾値は大きくなっていきますが、60-90分でピークに達した後は急性耐性が生じ、疼痛閾値が下がってきます。
Guignard B, Bossard AE, Coste C, et al.
Acute opioid tolerance. Intraoperative remifentanil increases postoperative pain and morphine requirement.
Anesthesiology 2000; 93: 409-17
腹部手術患者を、レミフェンタニル群(デスフルラン0.5MACに固定+レミフェンタニルを0.25㎍/㎏/分で開始し、鎮痛が不十分時に0.05㎍/㎏/分ずつ投与量を増加する)とデスフルラン群(レミフェンタニルを0.1㎍/㎏/分で固定+デスフルランを鎮痛状態に合わせてタイトレーションする)にわけて調査しています。レミフェンタニル群では、平均投与速度は0.3㎍/㎏/分に達していました。手術終了30分前に、モルヒネ0.15㎎/㎏を単回静脈内投与し、術後の鎮痛状態を比較したところ、Figure 2のようになっています。上部はデスフルラン群、下部がレミフェンタニル群の結果ですが、黒バーが痛みの訴えがない状態、グレーが痛みの訴えがあり、白が痛みの訴えが強い状態を表しています。レミフェンタニル群ではグレーの率が有意に高くなっています。
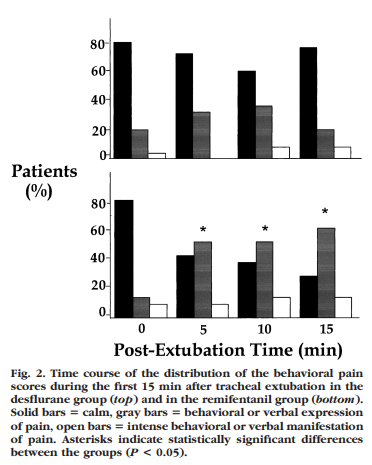
Figure 4には術後24時間のVASを図示していますが、レミフェンタニル群でより高値を示しています。
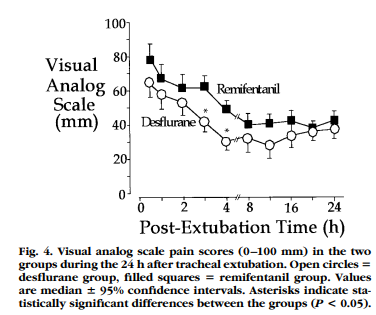
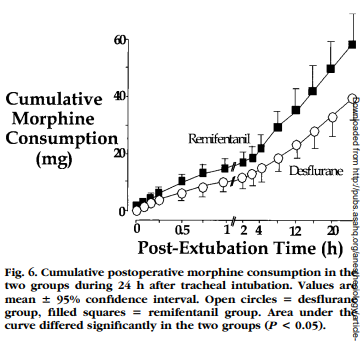
Figure 6は、鎮痛に要した累積モルヒネ量を表していますが、レミフェンタニル群ではデスフルラン群の倍量を要していました(59㎎vs 32㎎/24時間)。
この論文からは、レミフェンタニルで急性耐性が生じること、そして耐性はdose-dependentで投与量が多いほど出現しやすいこと、その耐性が術後鎮痛に影響することが示されています。
次は、OIHに関するデータを示します。
Joly V, Richebe P, Guignard B, et al.
Remifentanil-induced postoperative hyperalgesia and its prevention with small-dose ketamine.
Anesthesiology 2005; 103: 147-55
やはり腹部手術患者を対象に、レミフェンタニル少量投与群(0.05㎍/㎏/分)、高用量投与群(0.4㎍/㎏/分)、高用量投与(0.4㎍/㎏/分)+ケタミン投与群(導入時0.5㎎/㎏+術中維持5㎍/㎏/分、術後2㎍/㎏/分、48時間維持)にわけて、術後の疼痛状況とモルヒネ投与量を調査しています。
結果ですが、創部近傍でのアロディニアテストでは、Fig.1のようにレミフェンタニル高用量投与群で、疼痛閾値が有意に低下していました。
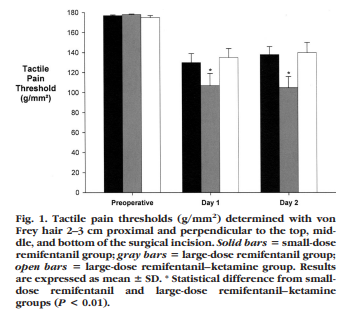
Fig.2のように、創部中枢側の痛覚過敏テストにおいても、やはり高用量投与群で有意に強度になっていました。
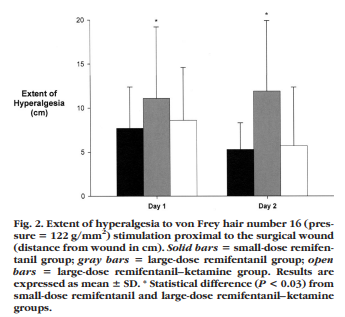
モルヒネの平均累積投与量は、少量投与群(68㎎/48時間)、高用量+ケタミン併用群(62㎎/48時間)に比し、高用量投与群では86㎎/48時間と有意に多くなっていました。この研究では、ケタミンによるNMDA 受容体拮抗作用が、OIHを回避できるとの重要な結果を示したといえます。OIHのメカニズムとして、NMDA 刺激が重要な因子のひとつであると推定されます。
麻酔中に、血圧や脈拍数のコントロール不良から鎮痛が不十分かなと思った場合、レミフェンタニルへの急性耐性が生じているかもと疑ってみることも必要でしょう。
特殊な回避手段を取らずとも、簡単な急性耐性への対応策が示されています。
Han S, Do SH, Kim Th, et al.
Stepwise tapering of remifentanil at the end of surgery decreased postoperative pain and the need of rescue analgesics after thyroidectomy.
BMC Anesthesiol 2015; 15: 46
甲状腺摘出術時の麻酔で、レミフェンタニルを0.3㎍/㎏/分で維持し、手術終了時にそのまま投与中止にするコントロール群と、少なくとも30分かけて0.1㎍/㎏/分まで漸減してから中止する群で、30分後および2時間後のVASには、50 vs 20、40 vs 30と有意差が認められています。24時間で必要としたレスキューの鎮痛薬回数も、3回 vs 2回と差が出ています。現状、機序は不明です。


